Kaip veikia ir veikia baterijos
 Plačiausia šio žodžio prasme technologijose sąvoka „baterija“ reiškia įrenginį, kuris tam tikromis veikimo sąlygomis leidžia kaupti tam tikros rūšies energiją, o kitomis – panaudoti žmogaus poreikiams.
Plačiausia šio žodžio prasme technologijose sąvoka „baterija“ reiškia įrenginį, kuris tam tikromis veikimo sąlygomis leidžia kaupti tam tikros rūšies energiją, o kitomis – panaudoti žmogaus poreikiams.
Jie naudojami ten, kur reikia tam tikrą laiką rinkti energiją, o vėliau ją panaudoti dideliems darbo jėgos procesams atlikti. Pavyzdžiui, šliuzuose naudojami hidrauliniai akumuliatoriai leidžia laivams upės vagoje pakilti į naują lygį.
Elektros baterijos veikia su elektra tuo pačiu principu: pirmiausia kaupia (akumuliuoja) elektrą iš išorinio įkrovimo šaltinio, o vėliau atiduoda prijungtiems vartotojams dirbti. Pagal savo pobūdį jie priklauso cheminiams srovės šaltiniams, galintiems pakartotinai atlikti periodinius iškrovimo ir įkrovimo ciklus.
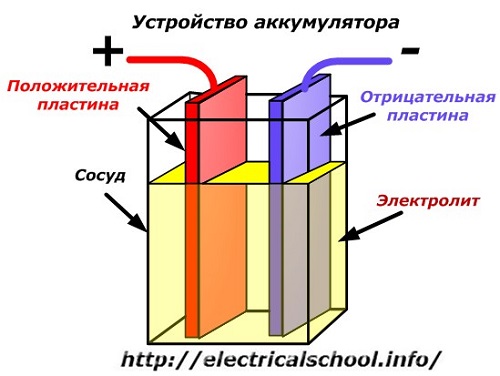
Eksploatacijos metu tarp elektrodų plokštelių komponentų nuolat vyksta cheminės reakcijos su jų užpildymo medžiaga – elektrolitu.
Akumuliatoriaus įrenginio scheminė schema gali būti pavaizduota supaprastintu brėžiniu, kai į indo korpusą įkišamos dvi skirtingų metalų plokštės su laidais, kad būtų užtikrintas elektros kontaktas. Tarp plokščių pilamas elektrolitas.
Baterija veikia išsikrovus
Kai prie elektrodų prijungiama apkrova, pavyzdžiui, lemputė, susidaro uždara elektros grandinė, kuria teka iškrovos srovė. Jis susidaro judant elektronams metalinėse dalyse ir anijonams su katijonais elektrolite.
Šis procesas paprastai parodytas diagramoje su nikelio-kadmio elektrodo konstrukcija.
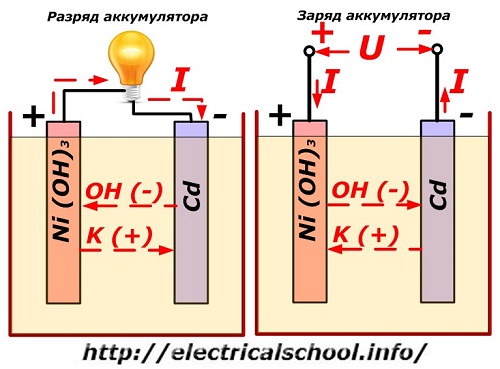
Čia kaip teigiamo elektrodo medžiaga naudojami nikelio oksidai su grafito priedais, kurie padidina elektros laidumą. Neigiamo elektrodo metalas yra kempinė kadmis.
Iškrovimo metu aktyvios deguonies dalelės iš nikelio oksidų patenka į elektrolitą ir nukreipiamos į neigiamas plokštes, kur oksiduojamas kadmis.
Akumuliatoriaus veikimas kraunant
Kai apkrova išjungiama, plokštės gnybtuose yra didesnė pastovi (tam tikromis situacijomis pulsuojanti) įtampa nei įkrauto tokio paties poliškumo akumuliatoriaus, kai šaltinio ir vartotojo pliusiniai ir minusiniai gnybtai sutampa. .
Įkroviklis visada turi daugiau galios, kuri „slopina“ likutinę energiją akumuliatoriuje ir sukuria priešingos iškrovos krypties elektros srovę. Dėl to pasikeičia vidiniai cheminiai procesai tarp elektrodų ir elektrolito. Pavyzdžiui, ant nikelio-kadmio plokščių dėžutės teigiamas elektrodas yra praturtintas deguonimi, o neigiamas - iki gryno kadmio būsenos.
Išsikrovus ir įkraunant akumuliatorių, keičiasi plokštelių (elektrodų) medžiagos cheminė sudėtis, tačiau nesikeičia elektrolitas.
Akumuliatoriaus prijungimo būdai
Lygiagretus ryšys
Iškrovos srovės dydis, kurį žmogus gali atlaikyti, priklauso nuo daugelio veiksnių, bet pirmiausia nuo konstrukcijos, naudojamų medžiagų ir jų matmenų. Kuo didesnis plokščių plotas prie elektrodų, tuo didesnę srovę jos gali atlaikyti.
Šis principas naudojamas lygiagrečiai baterijose sujungti to paties tipo elementus, kai reikia padidinti srovę iki apkrovos.Bet norint įkrauti tokią konstrukciją, reikės padidinti šaltinio galią. Šis metodas retai naudojamas paruoštoms konstrukcijoms, nes dabar daug lengviau iš karto įsigyti reikiamą bateriją. Tačiau rūgščių akumuliatorių gamintojai jį naudoja, sujungdami skirtingas plokštes į atskirus blokus.
Serijinis ryšys
Priklausomai nuo naudojamų medžiagų, tarp dviejų kasdieniame gyvenime įprastų baterijų elektrodų gali susidaryti 1,2 / 1,5 arba 2,0 voltų įtampa. (Tiesą sakant, šis diapazonas yra daug platesnis.) Akivaizdu, kad daugeliui elektros prietaisų to nepakanka. Todėl to paties tipo akumuliatoriai jungiami nuosekliai, ir tai dažnai daroma vienu atveju.
Tokio dizaino pavyzdys yra plačiai paplitusi automobilių plėtra, pagrįsta sieros rūgšties ir švino elektrodų plokštėmis.
Paprastai tarp žmonių, ypač tarp transporto vairuotojų, įprasta bet kurį įrenginį vadinti baterija, nepaisant jo sudedamųjų dalių – dėžučių – skaičiaus. Tačiau tai nėra visiškai teisinga.Konstrukcija, surinkta iš kelių nuosekliai sujungtų dėžių, jau yra baterija, kuriai priklijuotas sutrumpintas pavadinimas «АКБ»... Jo vidinė struktūra parodyta paveikslėlyje.
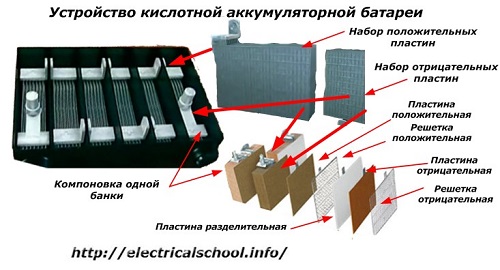
Kiekvienas stiklainis susideda iš dviejų blokų su plokščių rinkiniu teigiamam ir neigiamam elektrodams. Blokai telpa vienas į kitą be metalinio kontakto su galimybe patikimai galvaniškai jungtis per elektrolitą.
Šiuo atveju kontaktinės plokštės turi papildomą tinklelį ir yra atskirtos viena nuo kitos skiriamąja plokšte.
Plokščių sujungimas blokais padidina jų darbinį plotą, sumažina bendrą visos konstrukcijos atsparumą ir leidžia padidinti prijungtos apkrovos galią.
Dėžutės išorėje tokia baterija turi elementus, pavaizduotus paveikslėlyje žemiau.
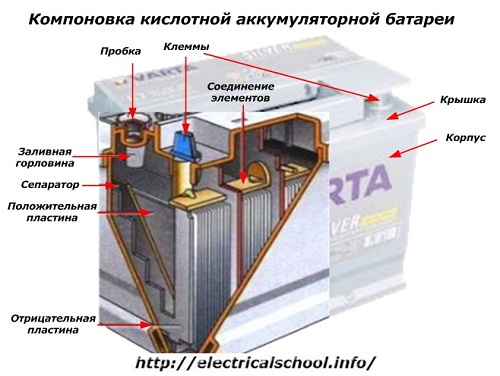
Tai rodo, kad tvirtas plastikinis korpusas yra užsandarintas dangteliu, o viršuje yra du gnybtai (dažniausiai kūgio formos), skirti prijungti prie automobilio elektros grandinės. Ant jų gnybtų yra įspausti poliškumo ženklai: «+» ir «-«. Paprastai teigiamas gnybtas turi šiek tiek didesnį skersmenį nei neigiamas gnybtas, kad blokuotų laidų klaidas.
Eksploatuotinos baterijos turi užpildymo angą kiekvieno stiklainio viršuje, kad būtų galima valdyti elektrolito lygį arba darbo metu įpilti distiliuoto vandens. Į jį įsukamas kištukas, kuris apsaugo vidines korpuso ertmes nuo užteršimo ir tuo pačiu neleidžia elektrolitui išsilieti pakreipiant akumuliatorių.
Kadangi su galingu įkrovimu galimas dujų išleidimas iš elektrolito (o šis procesas įmanomas intensyviai važiuojant), kamščiuose daromos skylės, kad slėgis dėžutės viduje nepadidėtų.Per juos išeina deguonis ir vandenilis, taip pat elektrolitų garai. Rekomenduojama vengti tokių situacijų, susijusių su per didelėmis įkrovimo srovėmis.
Tame pačiame paveikslėlyje parodytas elementų sujungimas tarp bankų ir elektrodų plokščių išdėstymas.
Automobilio starterio akumuliatoriai (švino rūgštis) veikia dvigubos sulfatacijos principu. Iškrovimo / įkrovimo metu ant jų vyksta elektrocheminis procesas, lydimas aktyviosios elektrodų masės cheminės sudėties pasikeitimo, kai elektrolite (sieros rūgštyje) išsiskiria / absorbuojamas vanduo.
Tai paaiškina elektrolito savitojo svorio padidėjimą įkraunant ir mažėjimą, kai baterija išsikrauna. Kitaip tariant, tankio vertė leidžia įvertinti akumuliatoriaus elektrinę būklę. Jam matuoti naudojamas specialus prietaisas – automobilio hidrometras.
Distiliuotas vanduo, kuris yra rūgščių akumuliatorių elektrolito dalis, esant neigiamai temperatūrai, virsta kietu – ledu.Todėl, kad automobilių akumuliatoriai neužšaltų šaltu oru, būtina taikyti specialias taisyklėse numatytas priemones. išnaudojimui.
Kokių tipų baterijos yra?
Šiuolaikinėje įvairios paskirties gamyboje gaminama daugiau nei trys dešimtys skirtingų elektrodų ir elektrolitų sudėties gaminių. 12 žinomų modelių veikia tik su ličiu.

Kaip metalinį elektrodą galima rasti:
-
vadovauti;
-
geležies;
-
ličio;
-
titanas;
-
kobaltas;
-
kadmis;
-
nikelis;
-
cinko;
-
sidabras;
-
vanadis;
-
aliuminio
-
kai kurie kiti daiktai.
Jie turi įtakos elektros išėjimo charakteristikoms, taigi ir pritaikymui.
Švino-rūgšties akumuliatoriams būdingas gebėjimas atlaikyti trumpalaikes dideles apkrovas, atsirandančias dėl vidaus degimo variklių alkūninio veleno sukimosi elektriniais starteriais. Jie plačiai naudojami transporte, nepertraukiamo maitinimo šaltiniuose ir avarinėse elektros sistemose.
Standartinis galvaniniai elementai (įprastos baterijos) dažniausiai pakeičiamos nikelio-kadmio, nikelio-cinko ir nikelio-metalo hidrido baterijomis.
Tačiau ličio jonų arba ličio polimerų konstrukcijos patikimai veikia mobiliuosiuose ir skaičiavimo įrenginiuose, statybos įrankiuose ir net elektrinėse transporto priemonėse.
Priklausomai nuo naudojamo elektrolito tipo, akumuliatoriai yra:
-
rūgštus
-
šarminis.
Yra baterijų klasifikacija pagal paskirtį. Pavyzdžiui, šiuolaikinėmis sąlygomis atsirado prietaisų, kurie naudojami energijos perdavimui – kitų šaltinių įkrovimui. Vadinamoji išorinė baterija padeda daugelio mobiliųjų įrenginių savininkams, kai nėra kintamo elektros tinklo. Jis gali pakartotinai įkrauti planšetinį kompiuterį, išmanųjį telefoną, mobilųjį telefoną.
Visos šios baterijos turi tą patį veikimo principą ir panašų įrenginį. Pavyzdžiui, žemiau esančiame paveikslėlyje parodytas ličio jonų piršto modelis daugeliu atžvilgių pakartoja anksčiau aptartą rūgštinių baterijų konstrukciją.
Čia matome tuos pačius kontaktinius elektrodus, plokštes, separatorių ir korpusą. Tik jie gaminami atsižvelgiant į kitas darbo sąlygas.
Pagrindinės akumuliatoriaus elektrinės charakteristikos
Įrenginio veikimą įtakoja parametrai:
-
talpa;
-
energijos tankis;
-
savaiminis išsikrovimas;
-
temperatūros režimas.
Talpa vadinama maksimaliu akumuliatoriaus įkrovimu, kurį ji gali atiduoti išsikrovimo metu iki žemiausios įtampos. Jis išreiškiamas pakabukais (SI sistema) ir ampervalandėmis (nesisteminis vienetas).
Kaip talpos tipas yra „energijos talpa“, kuri lemia iškrovos metu išsiskiriančią energiją iki minimalios leistinos įtampos. Jis matuojamas džauliais (SI) ir vatvalandėmis (ne SI vienetais).
Energijos tankis išreiškiamas energijos kiekio ir akumuliatoriaus svorio arba tūrio santykiu.
Savaiminio iškrovimo atveju apsvarstykite galios praradimą po įkrovimo, kai nėra apkrovos gnybtuose. Tai priklauso nuo konstrukcijos ir dėl daugelio priežasčių pablogėja izoliacija tarp elektrodų.
Darbinė temperatūra turi įtakos elektrinėms savybėms ir esant rimtiems nukrypimams nuo gamintojo nurodytos normos gali sugadinti akumuliatorių. Karštis ir šaltis yra nepriimtini, jie turi įtakos cheminių reakcijų eigai ir aplinkos slėgiui dėžutės viduje.
